Nedanstående riktlinjer är till stor del saxade ur socialstyrelsens nya diabetesriktlinjer från 2010 kompletterade med riklinjer från läkemedelverket (3). Riktlinjerna är uppdaterade med de nya diabetesriktlinjerna från 2015 (5). För mer kokboksliknande riktlinjer finns nice:s hemsida www.nice.org.uk.cg66. Vidare finns en del riktlinjer på svensk förening för diabetologis hemsida.
Blodtryck
Högt blodtryck är den viktigaste orsaken till stroke, hjärtinfarkt, nedsatt cirkulation i benen och njursvikt och därmed till den minst fördubblade dödligheten vid diabetes. Vid typ 2-diabetes minskar strikt blodtryckskontroll risken för förtida död med 15 procent och för hjärtinfarkt och stroke med 20 procent. Blodtrycksbehandling vid typ 2-diabetes är centralt (prio 1).
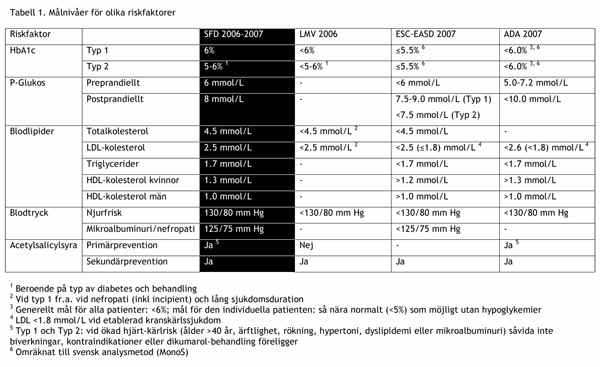
Målvärde
Måltrycket är generellt <130/80 mm Hg men bör utformas utifrån en individuell bedömning av nytta/risk. Enligt senare uppgift finns ganska svaga evidens för detta. Möjligen kommer systoliskt BT < 140 gälla framöver, lägre vid nefropati. Blodtrycksmålet måste också individualiseras enl nedan.
Användning av många läkemedel ökar risken för biverkningar, särskilt hos äldre, exempelvis blodtrycksfall vid diabetesorsakad nervskada.
Preparat
Blodtrycksbehandling med ACE-hämmare, angiotensinreceptorblockerare (ARB), betablockerare, kalciumblockerare och tiaziddiuretika ger alla en likvärdig riskreduktion för insjuknande och död när de används som förstahandsläkemedel vid typ-2 diabetes. Alla utom ARB anses som kostnadseffektiva och kan väljas som förstahandsbehandling. ARB kan användas vid intolerans mot ACE-hämmare.
Kombinationsbehandling med ACE- hämmare och ARB tycks göra mer skada än nytta.
Blodfetter
Blodfettrubbningar en de fyra viktigaste orsakerna till hjärtinfarkt men bidrar även till risken för stroke och nedsatt cirkulation i benen. Vid typ 2-diabetes med förhöjda kolesterolvärden minskar behandling med statiner risken för förtida död och insjuknande i hjärtinfarkt och stroke.
Vid typ 2-diabetes utan känd hjärtkärlsjukdom minskar behandling med statiner risken för akut kardiovaskulär händelse (död i koronarsjukdom, hjärtinfarkt, stroke och koronar revaskularisering) med 25 procent, från 12,1 till 10,0 procent.
Stora förändringar har skett i 2015 års rekommendationer (5). Patienterna bör numer riskstratifieras i NDR:s riskmotor dnr.nu/risk. Därifrån uppskattas 5-årsrisken för kardiovaskulär sjuklighet.
- Om risk < 2 % rekommenderas ingen farmakologisk behandling
- Om risk 2-8 % kan behandling erbjudas (prio 5).
- Om hög risk (8-20%) bör statinbehandling erbjudas (prio 2).
- Om mycket hög risk (> 20%) bör intensiv statinbehandling erbjudas (prio 1).
Målvärde
LDL-kolesterol bör ligga <1,8 mmol/l vid känd kranskärlssjukdom. I övrigt är det troligen behandlingen i sig och inte värdet som är det viktigaste. 2,5 mmol/l har länge används som behandlingsmål.
Preparat
Statiner är förstahandsbehandling. Fibrater får hög prio vid lågt HDL (prio 10).
Acetylsalisylsyra (ASA)
Vid typ 2-diabetes utan känd hjärtkärlsjukdom ger behandling med 80–100 mg ASA dagligen ingen effekt på total död, kardiovaskulär död eller kardiovaskulära händelser såsom hjärtinfarkt eller stroke. Forskning pågår. ASA som primärprofylax rekommenderas inte i nuläget (4, 5).
Rökning
Rökning är en de fyra viktigaste orsakerna till för tidig död, hjärtinfarkt, kärlkamp, stroke, nedsatt cirkulationen i benen samt njursvikt. Rökare har dessutom 15% lägre insulinkänslighet. Denna insulinresistens återställs efter 8 veckors rökstopp. Rökstopp minskar risk för IHD, neftropati etc.
Både kort rådgivning och läkemedel för rökavvänjning som ges tillsammans med råd om rökstopp ökar andelen patienter som lyckas. Sjukvården bör därför ge kort rådgivning om rökstopp till rökande patienter med diabetes (prio 1) och vid behov komplettera med nikotinersättningsmedel (prio 2).
Om otillräcklig effekt av dessa åtgärder ger behandling med vareniklin eller bupropion en patientnytta som överstiger olägenheten (prio 7).
Fysisk aktivitet
Regelbunden fysisk aktivitet har i ett folkhälsoperspektiv tydliga samband med minskad risk för hjärt-kärlsjukdom, typ 2-diabetes och övervikt. Regelbunden fysisk aktivitet vid typ 2-diabetes är lika effektivt som singel peroral terapi (1). Fysisk aktivitet har också visat sig vara lika effektivt på att förebygga övergång från IGT till DM som kostbehandling (1).
Regelbunden måttligt intensiv fysisk aktivitet vid typ 2-diabetes tycks ge en minskad risk för förtida död och hjärt-kärlsjukdom (kranskärlssjukdom och stroke), har en måttlig effekt på glukoskontrollen (minskar HbA1c med 0,6%) och är mycket kostnadseffektiv.
Personer med typ 2-diabetes har en ökad risk för hjärt-kärlsjukdom, varför rekommendationer om fysisk aktivitet utöver dagliga promenader bör föregås av omsorgsfull undersökning och anpassad rådgivning. Hälso- och sjukvården bör ge råd och stöd för ökad fysisk aktivitet till patienter med typ 2-diabetes (prio 1).
Minst trettio minuter motion/fysisk aktivitet dagligen rekommenderas.
Vissa risker föreligger vid insulinberoende diabetes
Kost
Fett: <30% , Protein: 15%, Komplexa kolhydrater: ca. 55%
Tallriksmodellen: 1/3 kött/fisk, 1/3 grönsaker och 1/3 pasta/ris/potatis
Regelbunden måltidsordning.
Blodsockerkontroll
Risken för både hjärt-kärlsjukdom och övriga komplikationer ökar med stigande plasmaglukosnivå och antal år man haft sjukdomen. Sambandet mellan HbA1c och hjärt-kärlsjukdom är inte lika starkt som för komplikationer orsakade av förändringar i de små kärlen (mikroangiopati). En nyligt publicerad artikel visar att varje procents ökning av HbA1c ger en 10% ökad risk för kardiovaskulär sjuklighet (Egg et al).
Vid typ 2-diabetes bidrar högt blodtryck, höga kolesterolnivåer, övervikt och fetma, särskilt bukfetma, till att öka risken för hjärt-kärlsjukdom. Förhållandet mellan risk och nytta varierar mellan olika individer och möjligen över tid. Ökad risk för hypoglykemier särskilt vid hjärtkärlsjukdom bör beaktas. Det finns också risk för varierande grad av viktökning beroende på val av läkemedel.
Intensivbehandling från debut av typ 2-diabetes utan känd hjärtkärlsjukdom minskar risken för utveckling av allvarliga skador på ögonbottnar, njurar och nerver. Efter lång tid minskar också risken för insjuknande i hjärtkärlsjukdom. Intensivbehandling vid typ 2-diabetes med lång varaktighet eller känd hjärtkärlsjukdom minskar risken för utveckling av allvarliga skador på ögonbottnar och njurar. Det råder osäkerhet om intensivbehandlingen minskar hjärtkärlsjukdom eller dödlighet om den påbörjas lång tid efter typ 2-diabetesdebut.
De tidigare studierna med UKPD-S-studien (och STENO-2?) i täten talar för att det är bra att pressa sockret så lågt som möjligt. Under 2008 kom 3 studier (ACCORD, ADVANCE och VAD-T) som talade för att intensivbehandling kan vara skadligt. Nyligen kom en metaanalys i Lancet (Effect of intensive control of glucose on cardiovascular outcomes and death in patients with diabetes mellitus: a meta-analysis of randomised controlled trials, Ray et al) som går igenom just dessa spörsmål.
Kost- och motionsbehandling som tidigare användes några månader är nu ute. I princip alla med typ 2-diabetesdiagnos bör erbjudas behandling med i första hand Metformin.
Målvärde
Det generella målet vid diabetes är HbA1c <52 mmol/mol men bör alltid utformas utifrån en individuell bedömning av nytta/risk (3). Vid nydebuterad typ 2-diabetes bör Metformin sättas in redan vid diagnos och sikta på normalt HbA1c. När målet är symptomfrihet är HbA1c < 75 mmol/mol rimligt (1, 3).
Frekvent svår hypoglykemi, svåra mikro- och makrovaskulära komplikationer, annan sjukdom och begränsad återstående livslängd kan vara motiv för högre nivå. Nydiagnostiserad diabetes, debut i lägre åldrar och låg risk för oupptäckt hjärtkärlsjukdom kan vara motiv för att eftersträva HbA1c-värden i eller nära normalområdet.
Hälso- och sjukvården bör från debuten av typ 2-diabetes utan känd hjärt-kärlsjukdom ha som målsättning att nå bästa möjliga blodsglukosnivå genom intensivbehandling (prio 1). Vid typ 2-diabetes med längre varaktighet eller med känd hjärtkärlsjukdom är vinsten med intensivbehandling mindre (prio 5).
Målsättningen bör modifieras med hänsyn till risken för hypoglykemi, förväntad återstående livslängd, annan sjukdom, kraftig viktuppgång eller nedsättning av livskvalitet.
Tablettbehandling
Följade grupper perorala diabetesläkemedel finns på den svenska marknaden (2010)
- Biguanider (Metformin®)
- Sulfonureider (Mindiab®, Glimepirid®, Amaryl®, Daonil®, Glibenklamid®). I första hand Mindiab, Glimepirid eller Amaryl som alla har generell subvention (2).
- Meglitinider (Repaglinid = Novonorm®). Hos meglitiniderna rekommenderas i första hand Novonorm av TLV men subvention endast till patienter som först provat metformin, SU eller insulin eller där dessa inte är lämpliga (2).
- Glitazoner (Pioglitazol = Actos®, Rosiglitazol = Avandia®)
- Alfa-glukosidashämmare (Akarbos = Glucobay®)
- GLP-1-analoger (Exenatid = Byetta®)
- DPP-4-hämmare = Inkretinläkemedel (Sitagliptin = Januvia®, Vildagliptin = Galvus®)
Förstahand
En patient med typ 2-diabetes bör i första hand få biguanider (prio 1).
Andrahand monoterapi
Patienter som inte tolererar metformin rekommenderas monoterapi med någon av följande:
- Insulin, SU eller Repaglinid (samtliga prio 4)
- DPP4-hämmare (prio 7)
- Akarbos (prio 9)
- Pioglitazon eller SGLT-2-hämmare (prio 10)
Tilläggsterapi andrahandsval
Om målen för glukosnivån inte uppnås med enbart metformin bör patienten få tillägg antingen av
- Insulin (prio 3)
- Sulfonureider eller repaglinid (båda prio 4)
- GLP-1-analog (prio 6)
- DPP4-hämmare (prio 7)
- Akarbos (prio 9)
- Pioglitazon eller SGLT-2-hämmare (prio 10)
Notera att Daonil förlorar sin subvention och generiskt Glibenklamid inte subventioneras vid nyinsättning (2). Metformin som monoterapi sänker HbA1c med c:a 1-1,5% vilket är likvärdigt med effekterna av sSU-preparat, glitazoner och GLP-analoger men är mer än för akarbos och DPP-4-hämmare (3). Följande läkemedel förlorar sin subvention 1 mars 2010 (2): Daonil (glibenklamid), Starlix (nateglinid), Avaglim (kombination).
Insulinbehandling
Insulinbehandling kan bli aktuellt vid dålig sockerkontroll och vid komplikationer eller vid intolerans mot perorala antidiabetika.
Vid behov av insulinbehandling bör NPH-insulin, kombinationsinsulin, 2-fas (prio 3) eller måltidsinsulin med eller utan NPH-insulin väljas som förstahandsval (prio 3). Vid upprepade hypoglykemier under behandling med NPH-insulin bör långverkande insulinanaloger väljas (prio 3) då dessa visat mindre hypoglykemirisk till dubblerad kostnad. Hälso- och sjukvården bör inte välja långverkande insulinanaloger (insulin glargin och insulin detemir) som förstahandsval (prio 9). Bland insulinberoende personer med typ 2-diabetes och hemsjukvård kan långverkande insulinanaloger vara kostnadsbesparande i ett samhällsekonomiskt perspektiv om det medför färre hembesök. Insulin degludek har låg prioritering vid avsaknad av hypoglykemier (prio 10) respektive vid hypoglykemier (prio 8).
Långverkande insulinanaloger (Lantus och Levemir) är endast subventionerade till patienter där annan insulinbehandling inte räcker till för att nå behandlingsmålet på grund av upprepade hypoglykemier (2), samtliga övriga insulinanaloger behåller generell subvention.
Snabbverkande
Mycket små doser (2-4 E) direktverkande insulin till måltid (3-dos) kan ibland vara bättre än medellångverkande till kvällen (endos) eller blandinsulin (2-dos). Framför allt tilltalande hos välmotiverade patienter där man vill pressa sockervärdena mycket lågt (HbA1c ner mot 5%) utan att för den delen riskera hypoglykemier.
Medellångverkande
- Insulatard till natten 0,1-0,2 E / kg (8E) att börja med. Öka med 2E varannan till var 3:e dag.
- Behåll tabletter tills P-glukos är bra och stabilt.
- Trappa därefter ner SU (metformin behålls) med 1 tabl / d.
| Insulatard till natten |
| fP-glu |
<5 |
5-7 |
7-9 |
9-11 |
> 11 |
| Justering av kvällsdos |
– 2E |
Samma dos |
+ 2E |
+ 4E |
+ 6E |
Blandinsulin
- Mixtard 70/30, NovoMix 30.
- Total dygnsdos oftas 0,5 E / kg kroppsvikt, enligt Bygren. Låter högt. Novo rekommenderar startdos 6E + 6E.
- Samma dygnsdos som medellångverkande (t.ex 30 E mot 30 E). Höj därefter till bra värden.
- 60% av dygnsdosen på morgonen, 40% på kvällen brukar bli bra.
| NovoMix 30 i tvådos |
| P-glu före mid |
<5 |
5-7 |
7-9 |
9-11 |
> 11 |
| Just av frukostdos |
– 2E |
Samma dos |
+ 2E |
+ 4E |
+ 6E |
| fP-glu |
<5 |
5-7 |
7-9 |
9-11 |
> 11 |
| Justering av middagsdos |
– 2E |
Samma dos |
+ 2E |
+ 4E |
+ 6E |
Behandlingstrappa
- Metformin
- Metformin + SU eller Metformin + Insulin
- Metformin + NPH-Insulin (när peroral behandling sviktar)
Egenkontroll
Diabetesvården bör erbjuda alla personer med insulinbehandlad diabetes systematisk egenmätning av blodglukos (prio 1).
När det däremot gäller patienter med typ 2-diabetes som inte behandlas med insulin bör diabetesvården i vanliga fall inte erbjuda systematisk egenmätning då detta har mycket liten effekt på HbA1c, 0,26 procentenheter efter 6 mån (icke-göra). Däremot kan det vara motiverat vid speciella situationer, som vid byte av läkemedel eller akut svängande blodglukos vid exempelvis infektioner, kortisonbehandling eller i pedagogiskt syfte (prio 3).
HbA1c mätning via filtrerpapper (post HbA1c) har lika hög tillförlitlighet som venöst prov vid både typ 1- och typ 2- diabetes (prio 4).
Övervikt
Mellan 40 och 50 procent av personer med typ 2-diabetes (diabetesdebut efter 30 års ålder som behandlas i primärvården) har BMI högre än 30, mellan 10 och 20 procent har BMI över 35 och omkring en tjugondel har BMI över 40.
Behandling av övervikt och fetma omfattar livsstilsåtgärder, kognitiv beteendeterapi (KBT), behandling med läkemedel och kirurgi. Med icke-kirurgisk behandling kan vikten minskas cirka fem procent på 1–2 års sikt, men vanligen uppnår man ingen bestående viktreduktion. Viktreducerande kirurgi reducerar vikten med drygt 25 procent upp till fem år efter operation. Efter tio år kvarstår en viktminskning om cirka 16–25 procent.
Farmaka
Två läkemedel, Orlistat (Xenical®) och Sibutramin (Reductil®), är godkända för behandling av övervikt och fetma vid typ 2-diabetes vid BMI (kroppsmasseindex) >28 kg/m2.
Vid typ 2-diabetes har Orlistat visat sig ge större viktnedgång och lägre HbA1c än med enbart livsstilsbehandling. Sibutramin har effekt på viktnedgång men inte HbA1c. Biverkningar skiljer mellan preparaten där gastrointestinala symtom dominerar för orlistat och puls- och blodtrycksstegring för sibutramin.
Underlaget är otillräckligt för att bedöma effekter av läkemedelsbehandling mot övervikt och fetma på hjärt-kärlsjukdom och dödlighet.
Hälso- och sjukvården kan vid typ 2-diabetes med övervikt eller fetma (BMI >28 kg/m2) ordinera orlistat som tillägg till livsstilsbehandling (prio 7). Sibutramin kan provas vid intolerans för orlistat (prio 10).
Kirurgi
Vid typ 2-diabetes med svår fetma leder fetmakirurgi beroende på sjukdomens varaktighet och behandling till normalisering av blodglukos i en utsträckning som varierar mellan olika studier (23–60 procent), minskat behov av diabetesläkemedel (29–74 procent) samt -1,1 procentenhet lägre HbA1c.
Med erfarna kirurger och stora operationsvolymer är risken för komplikationer låg, 1–2 procent. Operationen kan behöva göras om. Besvärande symtom på grund av för snabb tömning av magsäcken är vanligt. Plastikkirurgiska ingrepp kan behövas för att minska vävnadsöverskott på buken efter ingreppet.
Diabetesvården bör erbjuda fetmakirurgi till patienter med typ 2-diabetes med svår fetma (BMI >40 kg/m2, Prio 4). Under särskilda omständigheter som svårigheter att uppnå glukos– och riskfaktorkontroll kan diabetesvården överväga kirurgi även i BMI-intervallet 35–40 kg/m2 (Prio 7).
Information
Diabetesvården bör erbjuda gruppbaserad patientutbildning som leds av personer med såväl ämneskompetens som pedagogisk kompetens för att nå bästa tänkbara behandlingsresultat (prio 3). Detta har visat sig ge en betydande blodglukossänkning (HbA1c sjunker med i genomsnitt 0,8 procentenheter 12-24 mån efter). Om utbildningen leds av personer utan pedagogisk kompetens ses ingen positiv effekt varför detta inte bör utföras inom sjukvårdens ramar (inte-göra).
Hälso- och sjukvården bör erbjuda kulturellt anpassad utbildning i grupp till personer med diabetes och annan kulturell bakgrund (prio 4).
Screening för annan sjukdom
Vid långtidsbehandling med metformin vid typ 2-diabetes medför screening för brist på vitamin B12 vartannat år större patientnytta än olägenhet.
Tandvård
Vid diabetes har preventiva tandvårdsinterventioner mot parodontit och karies, t.ex. scaling, rotplaning och munhygieninstruktion, en patientnytta som överstiger olägenheten (prio 4). Se särskilt PM för tandvård och diabetes.
Referenser
- Attvall, Hanås, Östgren, Galley, Jandle. Diabetesdebatt. 091112.
- TLV: Genomgång av läkemedel vid diabetes. 2010.
- Läkemedelsverket: Läkemedelsbehandling vid typ 2-diabetes – ny rekommendation. Information från läkemedelsverket årgång 21, nr 1 feb 2010.
- Håkansson J: Lågdos-ASA bör inte ges som primärprofylax, läkartidningen nr 5 2010 volym 1067.
- Socialstyrelsen: Nationella riktlinjer för diabetesvård. 2015.